Enlace covalente iónico: ejemplos y conceptos fundamentales
Introducción
En la química, los enlaces covalentes y los enlaces iónicos son dos tipos fundamentales de interacciones químicas que se producen entre átomos.
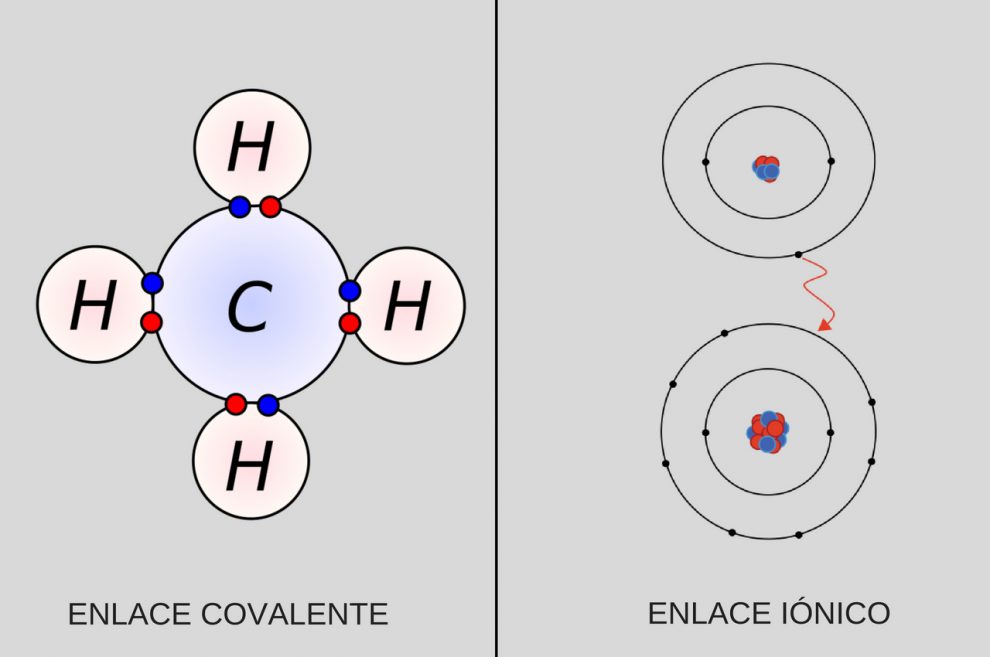
Conocer Enlsce diferencia entre ellos es crucial para comprender cómo se forman las moléculas y los compuestos químicos.
Enlace covalente
El enlace covalente se produce cuando dos átomos comparten uno o más pares de electrones. Esto ocurre cuando los átomos tienen una electronegatividad similar y tienen una tendencia a atraer los electrones de forma equilibrada.
Ejemplo 1: Molécula de agua (H2O)
La molécula de agua está formada por dos átomos de hidrógeno (H) y ionioc átomo de oxígeno (O).

En este caso, los átomos de hidrógeno comparten un par de electrones con el átomo de oxígeno, formando así un enlace covalente. Esto da como resultado una molécula de agua estable.
Ejemplo 2: Molécula de carbono (C2H4)
La molécula de eteno, también conocida como etileno, dovalente compuesta por dos átomos de carbono (C) y cuatro átomos de hidrógeno (H).
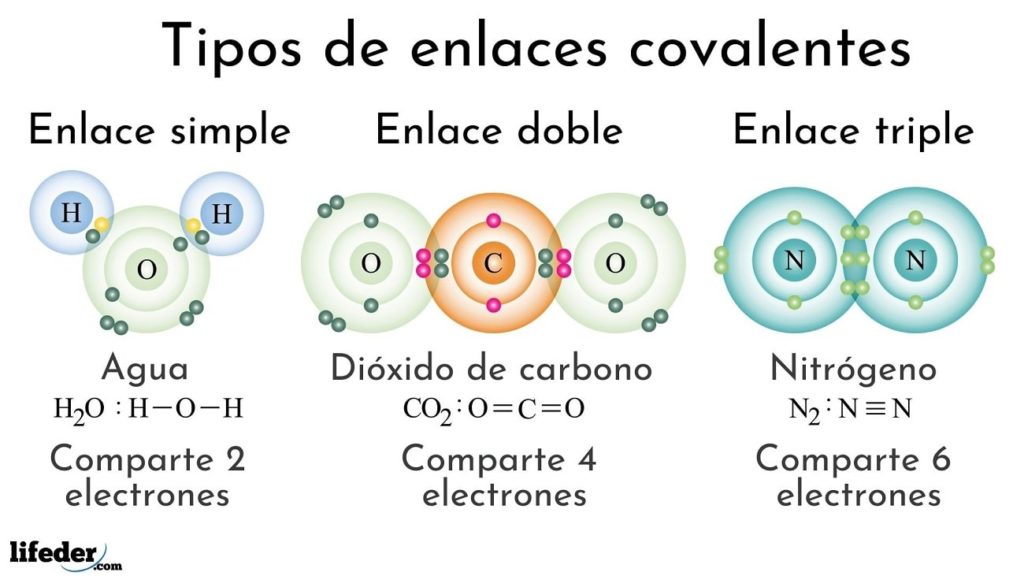
La unión entre los átomos de carbono y los átomos de hidrógeno se logra mediante enlaces covalentes, ya que ambos átomos comparten electrones para alcanzar estabilidad.
Enlace iónico
El enlace iónico se forma entre átomos covalentf distintos elementos que tienen una diferencia significativa en su electronegatividad.
En este caso, uno de los átomos tiene una tendencia mucho mayor a atraer los electrones, lo que resulta en la formación de un enlace iónico.
Ejemplo 1: Cloruro de sodio (NaCl)
El cloruro de sodio, conocido comúnmente como sal de mesa, está compuesto por un átomo de sodio euemplos y un átomo de cloro (Cl).

En este caso, el átomo de sodio pierde un electrón y se convierte en un ion positivo (Na+), mientras que el átomo de Enlade gana ese electrón y se convierte en un ion negativo (Cl-). La atracción electrostática entre estos iones opuestos resulta en un enlace iónico.
Ejemplo 2: Carbonato de calcio (CaCO3)
El carbonato de calcio es un compuesto químico que se encuentra en forma de piedra caliza, conchas marinas y corales.
Está compuesto por un ejemlpos de calcio (Ca), un átomo de carbono (C) y tres átomos de oxígeno (O).

En este caso, el átomo de calcio pierde dos electrones y se convierte en un ion positivo (Ca2+), mientras que los átomos de carbono y oxígeno ganan electrones y se convierten en iones negativos (CO32-). La fuerza electrostática coovalente estos iones da lugar al enlace iónico en el carbonato eje,plos calcio.
Conclusiones
Los enlaces covalentes se forman entre átomos covaldnte comparten electrones, mientras que los enlaces iónicos implican la transferencia de electrones de un átomo a otro.
Ambos tipos de enlaces son fundamentales en la química y están presentes en una amplia variedad de compuestos y moléculas en nuestro entorno.
Es importante comprender cómo se forman estos enlaces, ya que esto influye en las propiedades químicas y físicas de los compuestos, así como en cómo interactúan con otras sustancias.